联系我们
人支气管上皮
人呼吸道的支气管上皮层分为假复层(pseudostratified),纤毛(ciliated) 以及柱状(columnar)上皮。该区域主要有三种细胞类型:纤毛细胞 (ciliated cells),分泌细胞(secretory cells)(主要是分泌粘液的杯状细胞)和基底细胞(basal cells)。
支气管上皮作为保护屏障,防御各种吸入性伤害,例如毒素,污染物和病原体。屏障功能的维持主要基于于上皮的三个关键特征:
1. 紧密连接蛋白(tight junction proteins)维持着上皮的完整性,并且对于其作为物理屏障的功能至关重要。
2. 分泌细胞分泌的粘液会捕获颗粒物质和病原体,然后通过纤毛细胞的协同将这些颗粒物质和病原体通运出气道。
3. 粘液中含有抗菌肽(antimicrobial peptides)和炎症因子(inflammatory mediators)等保护性介质,形成了对病原体和有毒物质的化学和免疫屏障。
呼吸道上皮的生理相关模型的需求正在日益增长,但其挑战仍在于如何在体外重现体内组织的复杂结构和功能。
2D 气-液界面培养
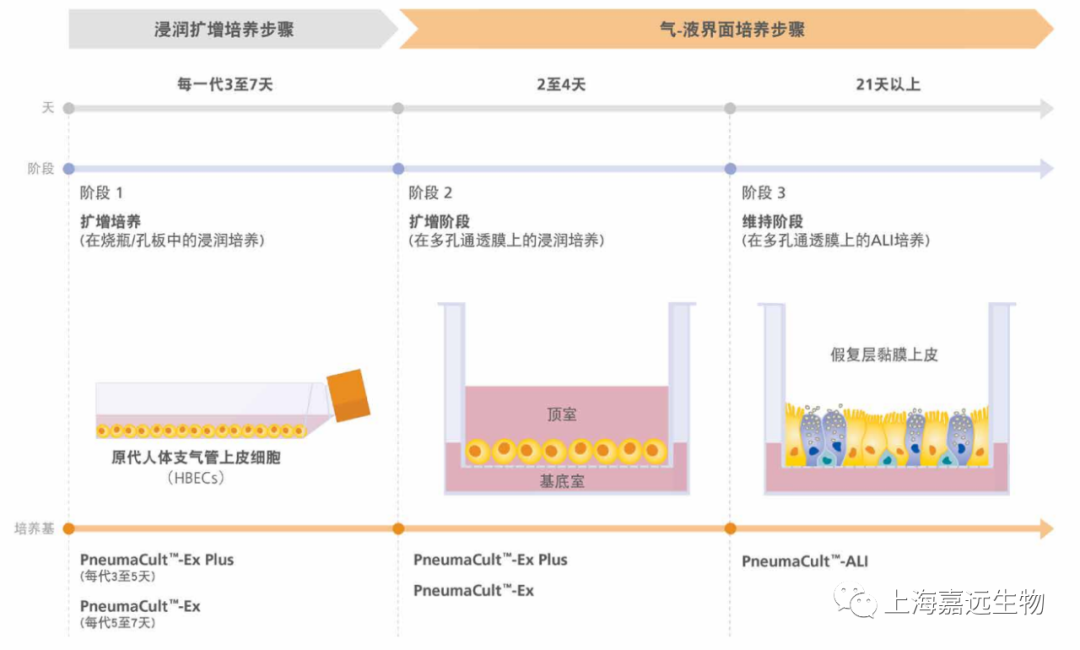
多种细胞类型可用于人类呼吸系统的建模,包括永生化的呼吸细胞系( 例如BEAS-2B细胞和16HBE14o-细胞)以及来自动物或人类供体的原代细胞。尽管使用永生化细胞系和动物原代细胞很普遍,但使用这些模型产生的数据并不直接适配于人类系统。传统培养人原代支气管上皮细胞的方法是将细胞浸没于培养基之下进行培养;但是,在该培养系统中的细胞无法进行粘膜纤毛分化。为了重现在体内观察到的伪分层粘膜纤毛表型(pseudostratified mucociliary phenotype),必须在气-液界面(AirLiquid Interface,ALI)上培养原代人支气管上皮细胞(primary human bronchial epithelial cells,HBEC)(图1)。
气-液界面培养的主要特征是细胞的基底表面与液体培养基接触,而其顶端表面则暴露于空气中。常见的细胞接种方法是将细胞接种到细胞培养插件(cell culture insert)的可渗透膜上。在细胞培养初期,顶端和基底的腔室都需要添加培养基(图1A)。当细胞数量接近满板时,需要对细胞“airlift”,即吹干顶端腔室的培养基,并保留基底腔室的培养基(图1B)。该培养系统模拟了人气道中的情况,诱导细胞向粘膜纤毛表型分化。
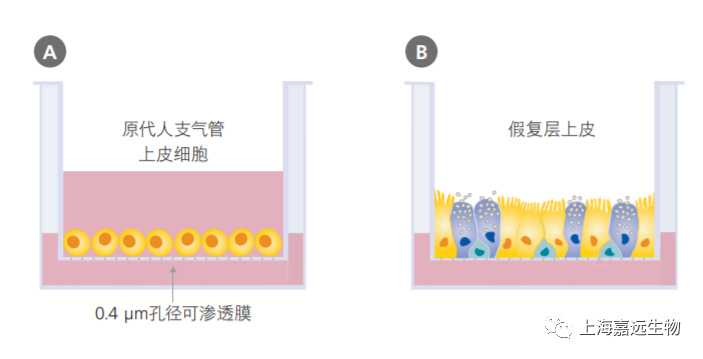
图1. 气-液界面培养的示意图
使用多孔细胞培养板进行培养的原代人支气管上皮细胞的浸没培养(A)以及气-液界面培养(B)示意图。

气-液界面培养的生理相关性
原代HBEC的气-液培养近年来越来越被认为是与呼吸系统生理学高度相关的重要培养系统。在气-液上培养的HBEC经历了高度的粘膜纤毛分化,从而形成了代表体内气道的体外模型。H&E(hematoxylin and eosin)和PAS(periodic acid-Schiff)染色显示气-液界面培养物(图2A和 2C),如同体内支气管上皮一样(图2B和2D),表现出伪分层的形态,以及异种细胞群的组成,包括纤毛和粘液分泌(PAS阳性)细胞。
该模型的特征还在于体现出上皮的屏障功能,例如表达紧密连接蛋白和高细胞跨膜电阻(high transepithelial electrical resistance)。通过转录组分析与细胞对毒素、病原体等外源物质的生理反应实验,进一步证实了气-液界面培养物对气道建模的高度适用性。此外,对来自患有呼吸系统疾病(例如哮喘,囊性纤维化,慢性阻塞性肺病)供体的原代细胞进行气-液界面培养,可以重现体内疾病特征,从而建立可靠的体外研究模型。
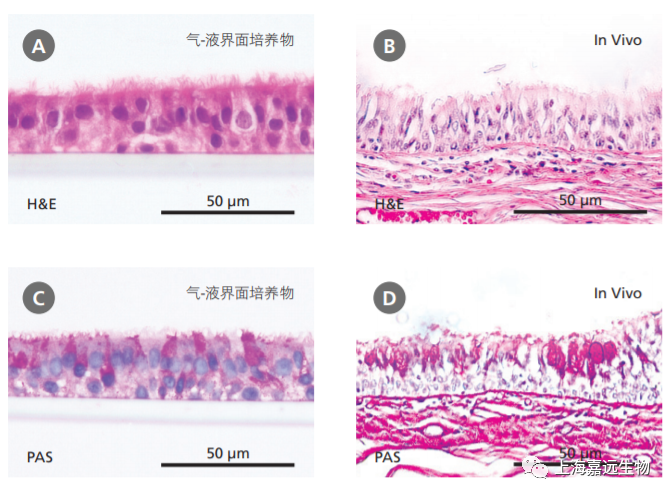
图2. 气-液界面培养的人支气管上皮原代细胞重现了体内支气管上皮的结构
(A-B)H&E和PAS的染色显示,PneumaCult™-ALI培养的气-液界面处分化的细胞形成了假复层上皮(A和C),表现出体内支气管上皮(B和D)的特点。(A)和(C)中的数据由 Samuel Wadsworth提供。
实验流程简图
气-液界面培养的应用
气-液界面培养在呼吸系统研究中具有巨大的潜力,拥有广泛的实验用途。其中诸多专业的实验,往往无法通过传统浸没培养模型进行。使用气道上皮细胞的气-液界面培养物可以:
• 研究呼吸道上皮的细胞生物学 气-液界面培养物是体外研究呼吸道上皮的生理学相关度最高的模型 。
• 建立呼吸系统疾病模型 使用气-液界面培养来培养患有慢性呼吸系统疾病(如哮喘,囊性纤维化,慢性阻塞性肺病)的患者的气道上皮细胞,从而可以在体外研究疾病的机制。
• 研究呼吸道上皮的感染一些呼吸道病毒只会有选择性地感染完全分化的气道上皮细胞。
• 测试吸入式药物的有效性气溶胶颗粒可以直接添加在半干的细胞顶端表面上,从而模拟粉末在体内沉积到肺的表面。
• 测试吸入物质的毒性气-液界面分化的原代上皮细胞对于吸入成分(例如烟草烟雾成分之类)的伤害反应与人体内气道的真实伤害反应极为相似。
3D成球培养
实验流程及数据
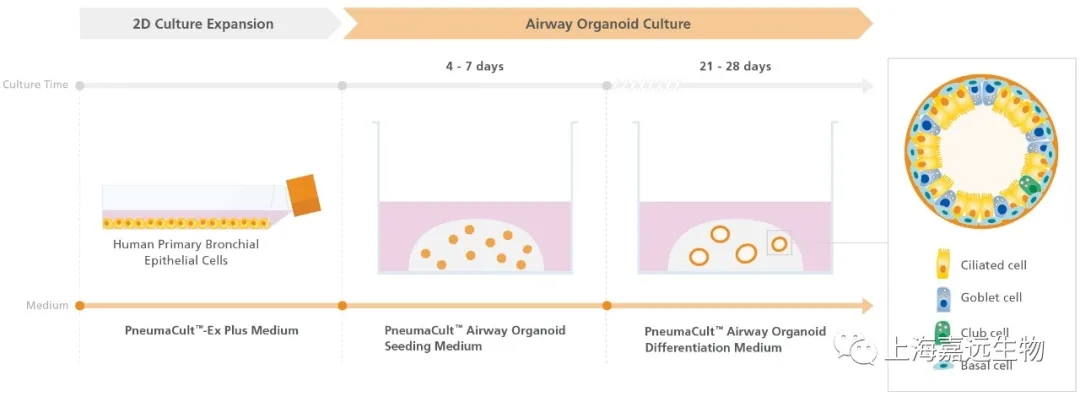
Figure 1. Overview of the PneumaCult™ Culture System for Human Airway Organoid Generation
In the early two-dimensional expansion phase of the human airway organoid culture procedure, HBECs are expanded using PneumaCult™-Ex Plus Medium. The HBECs are then embedded into a Matrigel® dome and expanded for 4 - 7 days using PneumaCult™ Airway Organoid Seeding Medium. Following the expansion, the HBECs are differentiated using PneumaCult™ Airway Organoid Differentiation Medium for an additional 21+ days.
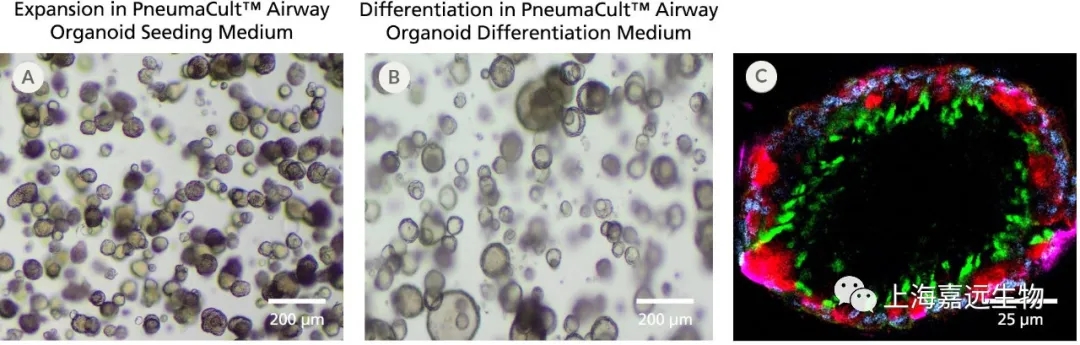
Figure 2. Fully Differentiated Human Airway Organoids Generated Using PneumaCult™ Airway Organoid Kit
(A) Bright-field image of airway organoids growing in PneumaCult™ Airway Organoid Seeding Medium at day 7 exhibit basal cell spheroid morphology. (B) Bright-field image of airway organoids differentiated in PneumaCult™ Airway Organoid Differentiation Medium at day 21 exhibit hollow lumens. (C) Airway organoid stained for ZO-1 (junction protein marker, red), MUC5AC (goblet cell marker, purple), AC-Tubulin (ciliated cell marker, green), and DAPI (nuclei, blue).
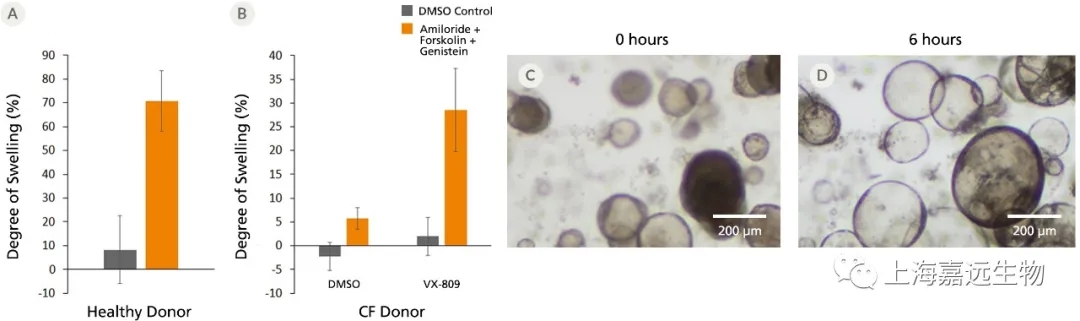
Figure 3. Forskolin-Induced Swelling of Airway Organoids
(A) Forskolin-treated organoids derived from healthy donors increased in size compared to the DMSO control, indicating functional CFTR protein expression. (B) Forskolin-induced swelling is lost in organoids derived from CF donors, but re-established in VX-809-treated airway organoids. Error bars represent ± 95% confidence interval for the mean (n=3). Bright-field images of airway organoids taken during the Forskolin swelling assay at (C) 0 hours and (D) 6 hours show organoid swelling after treatment.
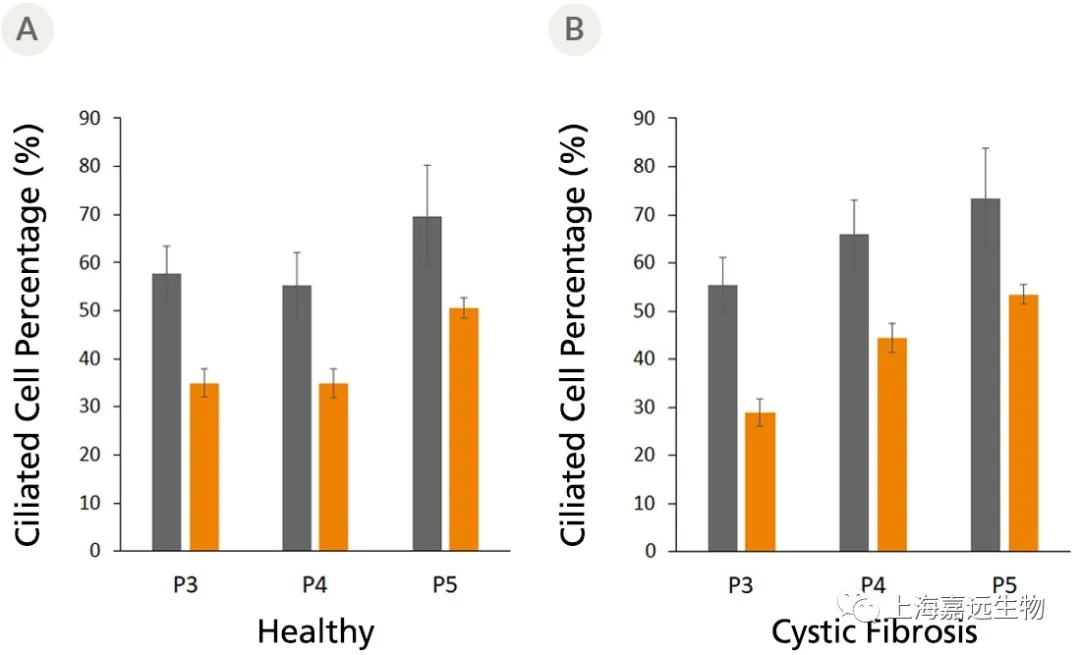
Figure 4. Fully Differentiated Airway Organoids Retain Morphological Characteristics at Different Passages
The ciliated cell percentage in organoids grown from (A) healthy and (B) CF donors using PneumaCult™ Airway Organoid Kit increased from P3 to P5. The total and ciliated cells were counted using a hemocytometer. Error bars represent ± 95% confidence interval for the mean (n=3).
产品信息
|
货号 |
名称 |
| 05040 | PneumaCult™-Ex Plus Medium |
| 05001(2D) |
PneumaCult™-ALI Medium |
| 05021(2D) |
PneumaCult™-ALI Medium with 12 mm Transwell® Insert |
| 05022(2D) |
PneumaCult™-ALI Medium with 6.5 mm Transwell® Insert |
| 05050(2D) |
PneumaCult™-ALI-S Medium |
| 05060(3D) |
PneumaCult™ Airway Organoid Kit |